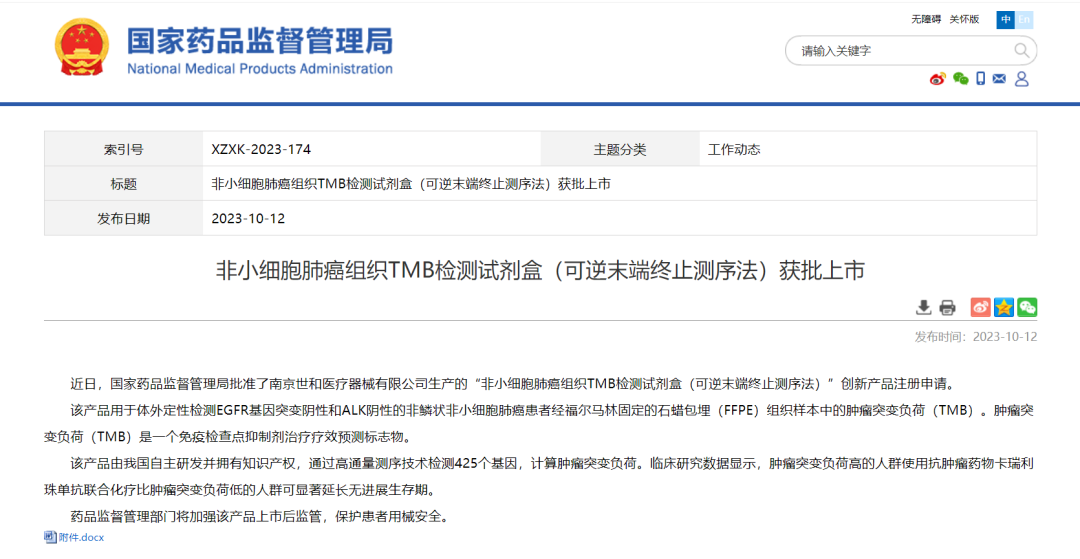
10月12日,NMPA官网显示南京世和医疗器械有限公司(以下简称“南京世和”)生产的“非小细胞肺癌组织TMB检测试剂盒(可逆末端终止测序法)”(以下简称“TMB检测试剂盒”)获批上市,这是一款创新产品。截至目前,国家药监局已批准231款创新医疗器械上市。
图片来源:NMPA官网
近年来,随着免疫检查点抑制剂(ICIs)成为肿瘤治疗领域的热点,免疫治疗疗效预测相关生物标志物的研究也受到越来越多关注。据了解,预测性生物标志物有助于揭示ICIs的治疗机制及肿瘤与肿瘤免疫微环境的相互作用机制,对肿瘤患者的临床治疗有着重要作用,包括个体化治疗、了解耐药机制及预后等。
据药监局官网显示,TMB检测试剂盒用于体外定性检测EGFR基因突变阴性和ALK阴性的非鳞状非小细胞肺癌患者经福尔马林固定的石蜡包埋(FFPE)组织样本中的肿瘤突变负荷(TMB)。肿瘤突变负荷(TMB)是一个免疫检查点抑制剂治疗疗效预测标志物。
该试剂盒由我国自主研发并拥有知识产权,通过高通量测序技术检测425个基因,计算肿瘤突变负荷。临床研究数据显示,肿瘤突变负荷高的人群使用抗肿瘤药物卡瑞利珠单抗联合化疗比肿瘤突变负荷低的人群可显著延长无进展生存期。
截至目前,国家药监局已批准20款试剂盒创新产品上市,具体如下:
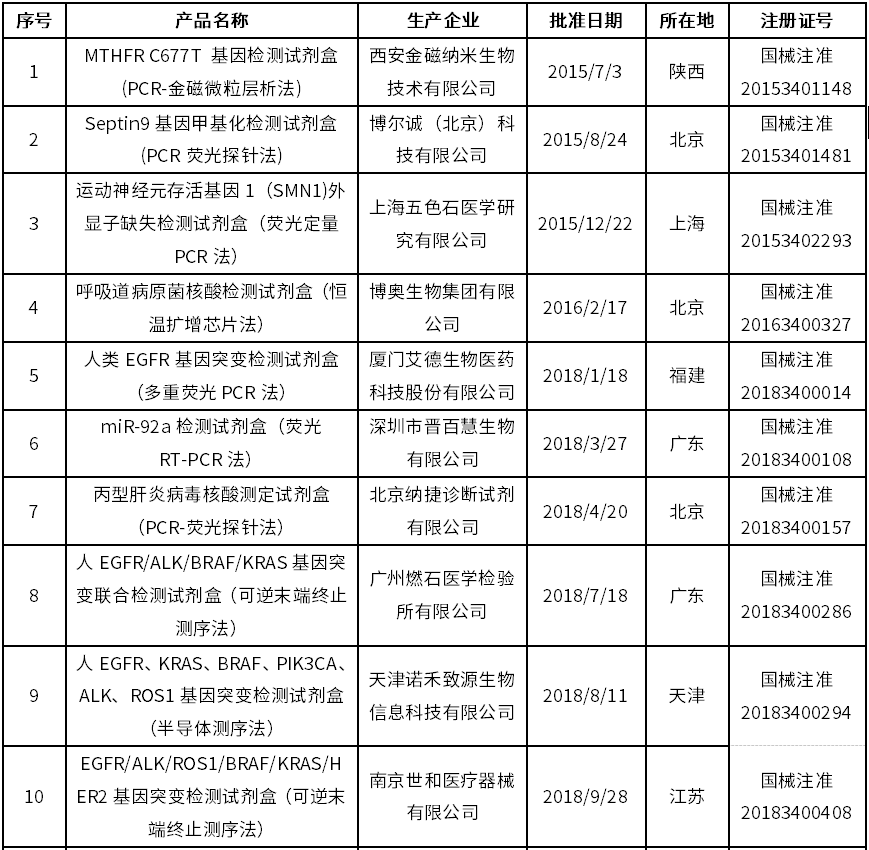
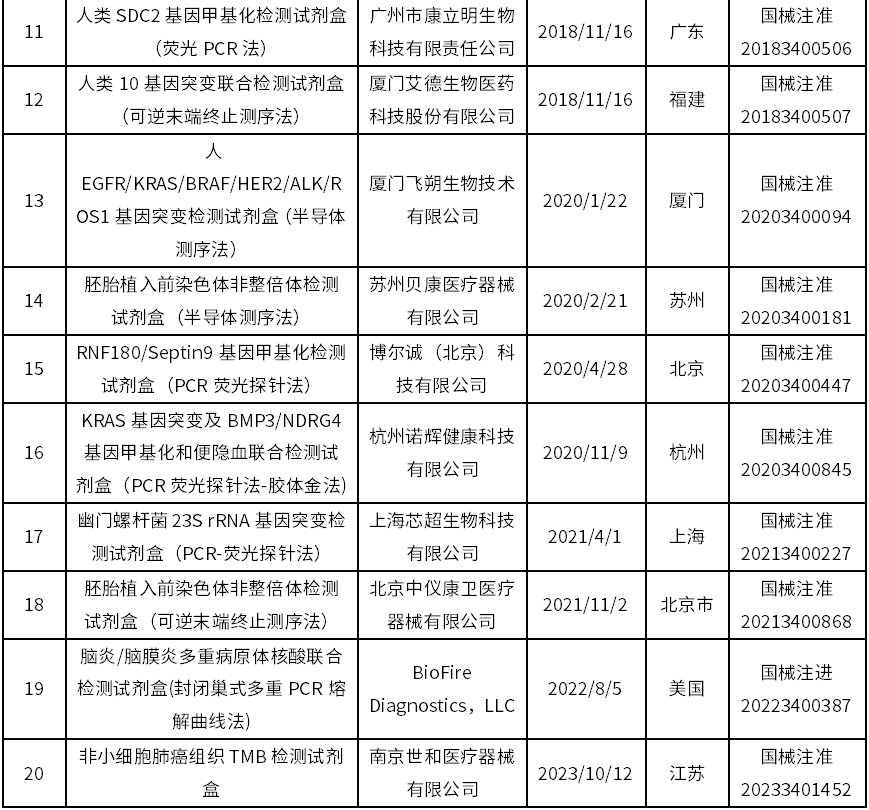
资料来源:《国家药监局已批准的创新医疗器械》目录
小结
当前免疫治疗已成为晚期驱动基因阴性肿瘤患者的重要治疗选择之一,而生物标志物作为预测免疫治疗的疗效及不良反应的重要手段,相关检测试剂盒的开发也将占据越来越重要的地位。
声明:本文仅作信息传递之目的,并不代表本平台观点。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间核实并处理。仅供读者参考,著作权、版权归属原创者所有。转载此文是出于传递更多正能量信息之目的,侵权删






 首页
首页

 癌症科普
癌症科普

 癌症种类
癌症种类

 药品百科
药品百科

 肿瘤医院
肿瘤医院

 名医专家
名医专家

 免费试新药
免费试新药

 健康资讯
健康资讯

 癌症新方案
癌症新方案













