KRAS靶点研发呈现出了“冰火两重天”。
近日,BMS以58亿美元收购Mirati,并获得其KRASG12C抑制剂Adagrasib,将KRAS靶向药物研发推向了新高潮。与此同时,首款获FDA批准上市的KRAS抑制剂Sotorasib却陷入难以转正的困局:确证性研究CodeBreaK200的主要研究终点(无进展生存期PFS)遭到FDA委员会质疑。
实际上,折戟是KRAS靶向药物研发的常态,这条路上,一直矗立着“不可成药”这座大山,这也吸引了无数挑战者争相攀登……
“完美”抗癌靶点,翻越“不可成药”大山
KRAS是RAS基因家族的一员,是其中最为常见的一类突变。自20世纪70年代被发现以来,KRAS一直是药物研发领域最关注的靶点之一,这是因为从理论上而言,KRAS是一种“完美”的癌症治疗靶点:
分布广泛:KRAS突变存在于约三分之一的人类肿瘤中,例如结直肠癌、胰腺导管腺癌、肺腺癌等,且多发生于癌症早期。
可区别于健康细胞:携带RAS突变的癌细胞强烈依赖于致癌形式的RAS蛋白,需在该蛋白处于“开启”生长状态时才能存活并生长,因此该类细胞与健康细胞能够被区别开来。
换言之,靶向KRAS的药物选择性足够高、毒副作用相对较小,是一种“完美”的抗癌疗法。
但事实上,KRAS靶点在被发现后的多年来,都被认为是“不可成药”靶点,直至2021年才有药物获批上市。KRAS靶点“不可成药”,是因为其蛋白过于“光滑”,药物难以楔入该蛋白中。好在,本世纪初,一项研究发现了KRAS的一种突变体——KRASG12C突变蛋白,这是KRAS靶向药物研发的一个突破口。目前两款获FDA加速批准上市的KRAS抑制剂,Sotorasib以及Adagrasib,均为KRASG12C抑制剂。
KRAS突变体是当下KRAS靶向药物研发的重要方向。近日,一篇发表在《Science》上的文章提出了一种三复合体选择性抑制KRAS突变体的药物开发策略,该策略通过建立KRAS突变体与亲环蛋白CYPA的结合界面,产生小分子抑制剂、CYPA与KRAS突变体的三复合体结构。研究者筛选到了两款药物,其中RMC-6291已进入临床试验。
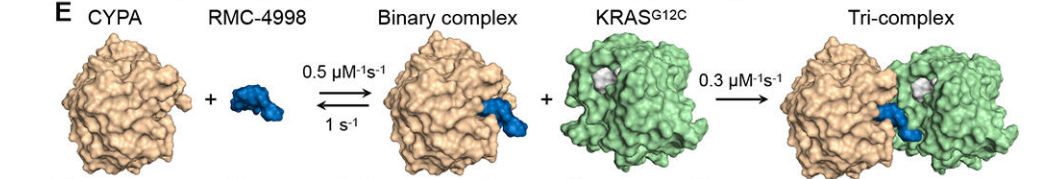
图片来源:参考资料2
此外,抗癌疫苗、TCR-T等新兴疗法也逐渐成为了KRAS靶向药物研发的新方式:Modern正在开发靶向KRAS突变的mRNA疫苗mRNA-5671,免疫肿瘤学平台公司Medigene将其专有的PD1-41BB开关受体结合的TCR-T细胞疗法管线扩展到了KRAS……
众多新兴疗法,均令人期待。
药智数据采访了广东伽楠沉香生物科技有限公司新药研究所所长肖弥彰博士。他1995年毕业于湖南大学,曾任职于中国科学院,在欧洲、韩国、加拿大等国的研究期间积累了靶向药物研发与注册申报经验。肖博士是一位资深的药物化学专家,专注于靶向肿瘤抗原的T细胞免疫疗法与近红外荧光成像探针导航实体瘤的精准切除。
肖博士对三复合体结构表现出了兴趣,他认为:“三复合体结构模拟了肿瘤免疫学分子机制。通过借助亲环蛋白CYPA,小分子抑制剂能高亲和力地靶向KRAS突变体,也带来了三大改变:增强亲和能力(抑制了内源性底物的竞争性结合);改变亲和策略(增设了结合口袋从而强化了小分子抑制剂靶向结合靶标的亲和力);改变抑制策略(小分子抑制剂间接地阻断靶标蛋白活性)。于是靶标不再是‘低酶活、难亲和、难抑制’。”
同时,肖博士提到了另一种三复合体结构:“PROTAC分子也是三复合体结构:与靶标蛋白结合的配体、与连接酶结合的配体,及结合前述两个配体的链接器。PROTAC利用泛素-蛋白酶体系统UPS诱导降解多种靶蛋白(核受体、表观遗传因子和激酶等)。高效抑制生长因子受体、酶类或其他靶点的药物正受到重视。”
此外,关于治疗性癌症疫苗(尤其是mRNA疫苗)、TCR-T,肖博士也提出了一些看法。他认为两种策略都受到了一定制约:“mRNA疫苗面临疫苗递送、识别癌细胞的不断突变的新抗原及外源物质mRNA免疫原性等关键问题,且还不能精准识别肿瘤特异性突变或不一致序列(在不同的癌症患者之间和甚至同一患者的不同病灶之间都可能不同)。”
“尽管当前已有研究证明TCR-T细胞疗法靶向KRASG12D突变能介导转移性胰腺癌肿瘤的消退,但TCR-T细胞疗法仍面对着一个关键问题:制备流程长(大致花费3~5个月)、以至于难于满足肿瘤患者的时效性临床需求。”
小结
事实上,KRAS突变中,G12C大约只占10%左右,G12D等常见突变形式以及G12V和G12S等罕见突变形式的药物研发存在着更大的困难。不过,前路漫漫亦灿灿,相信终有一天,研究者们能够成功征服这座“不可成药”大山。
来源:医药魔方,仅供读者参考,著作权、版权归属原创者所有。转载此文是出于传递更多正能量信息之目的,侵权删






 首页
首页

 癌症科普
癌症科普

 癌症种类
癌症种类

 药品百科
药品百科

 肿瘤医院
肿瘤医院

 名医专家
名医专家

 免费试新药
免费试新药

 健康资讯
健康资讯

 癌症新方案
癌症新方案













