为第四款上市的双抗产品,Rybrevant(Amivantamab)市场表现始终不温不火,究其原因,在于二线EGFR外显子20插入突变非小细胞肺癌患者人数较少,且市场有莫博替尼的冲击。但随着一线非小细胞肺癌适应症及奥希替尼耐药后线适应症的成功,Rybrevant有望迎来销售的快速放量。
在2023年ESMO上,Rybrevant凭借三项亮眼数据,在1L19号外显子缺失突变和21号外显子L858R点突变NSCLC、1L外显子20NSCLC和EGFR-TKI经治NSCLC市场脱颖而出。
(1)在1L19号外显子缺失突变和21号外显子L858R点突变NSCLC适应症上,与奥希替尼相比,Rybrevant联合拉泽替尼mPFS达23.7个月,显著优于奥希替尼的16.6个月,HR为0.7。
(2)在1L外显子20突变的NSCLC适应症上,与化疗相比,Rybrevant联合卡铂和培美曲塞的mPFS达11.4个月,显著优于化疗的6.7m(HR=0.4)。
(3)在EGFR-TKI经治NSCLC适应症上,Rybrevant联合拉泽替尼、卡铂和培美曲塞的mPFS达8.3m,显著优于化疗的4.2个月(HR=0.44)。
拳打奥希替尼,脚踢化疗,三项适应症的优异数据标志着EGFR/cMET双抗的胜利,当之无愧ESMO最闪亮的药物。
EGFR/c-MET双抗:一款上市,一款二期,四款处于一期临床
EGFR/c-MET双抗剑指1LNSCLC和EGFRTKI耐药后NSCLC市场。传统EGFR-TKI已发展至第三代,患者用药后产生了较为复杂的耐药性。在一代/二代TKI抑制剂的耐药机制中,由于MET基因扩增导致的耐药占据5%,仅次于EGFRT790M突变及HER2基因扩增;在三代TKI抑制剂的耐药机制中,由于MET基因扩增导致的耐药的患者比例更高达15%—19%,所以靶向EGFR和c-MET的双抗药物可用于治疗EGFR-TKI无效或耐药患者。此外,MET基因扩增是NSCLC原发的驱动突变,在未接受过TKI靶向治疗的非小细胞肺癌患者中MET基因扩增的比例约2%—4%。因此,MET基因扩增是肺癌治疗的重要靶点。
目前多个药厂布局EGFR/c-MET双靶点药物开发,包括1款上市产品,为强生的Rybrevant;一款产品处于临床Ⅱ期,为ChongKunDangPharmaceutical的CKD-702;四款产品处于临床Ⅰ期,包括岸迈生物的EMB-01、贝达药业的MCLA-129、豪森药业的HS-20117和礼来的LY3164530。部分企业布局了三特异性抗体,包括嘉和生物的GB263T和拓创生物的TAVO412。
表:EGFR/cMET双抗在研格局
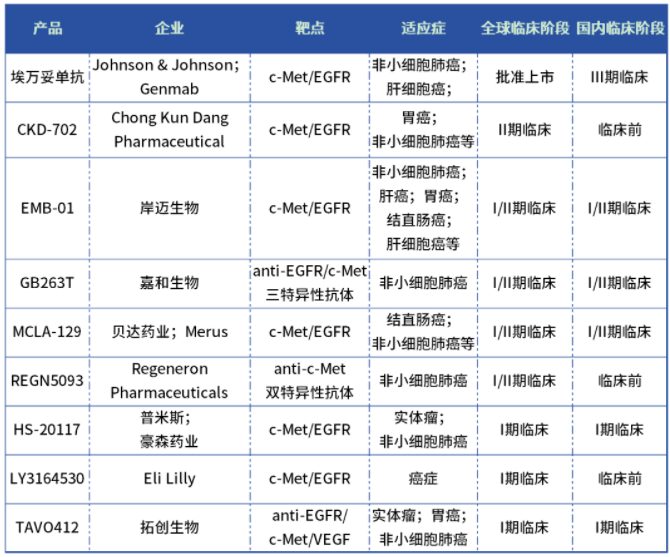
数据来源:药智数据、企业公告等公开资料
Rybrevant:一线治疗NSCLC及奥希替尼耐药后NSCLC均获得积极顶线数据
Rybrevant((Amivantamab,埃万妥单抗))是强生旗下一款全人源的IgG1双抗,FAB端分别靶向EGFR和cMet。Rybrevant具有三大作用机制:
第一,Rybrevant与肿瘤细胞表面的EGFR和c-Met受体结合,抑制EGFR和c-Met信号通路;
第二,Rybrevant可以降解EGFR和c-Met受体,直接从源头上阻断信号通路;
第三,Fc端介导的ADCC作用,招募免疫细胞杀灭肿瘤细胞。
2021年5月21日,FDA加速批准了Rybrevant上市,用于治疗铂类化疗后进展的EGFR外显子20插入突变的转移性非小细胞肺癌(NSCLC)患者。Rybrevant加速批准是基于Ⅱ期CHRYSALIS(NCT02609776)研究的结果,对81例接受含铂化疗期间或之后病情进展、携带EGFR外显子20插入突变的NSCLC成人患者评估了Rybrevant的疗效。疾病进展后均接受Amivantamab治疗。体重<80kg的患者接受1050mg剂量,体重≥80kg患者的剂量为1400mg。
结果显示,Amivantamab治疗显示出持久的缓解:总缓解率(ORR)为40%,中位缓解持续时间(DOR)为11.1个月。在病情缓解的患者中,有63%缓解持续时间≥6个月。
Rybrevant一线治疗NSCLC及奥希替尼耐药后NSCLC均获得积极顶线数据。2023年9月28日,强生宣布,Rybrevant联合第三代EGFR抑制剂Lazertinib头对头奥希替尼治疗EGFR突变局部晚期或转移性非小细胞肺癌(NSCLC)患者的III期MARIPOSA研究获得积极顶线数据。除了一线治疗NSCLC外,Rybrevant联合第三代EGFR抑制剂lazertinib及化疗治疗奥希替尼耐药后的非小细胞肺癌(NSCLC)患者的III期MARIPOSA-2研究于2023年9月获得积极顶线数据。
EGFR/cMET双抗:潜力巨大,群雄割据
(1)CKD-702是ChongKunDangPharmaceutical旗下一款EGFR/c-MET双抗,目前处于临床Ⅱ期。在2022年ESMO上,ChongKunDangPharmaceutical披露了CKD-702的Ⅰ期数据,24名受试者中观察到5例PR,其中六名MET14跳跃突变患者中观察到三例PR(均为一线治疗的受试者)。安全性方面,未观察到DLT,41.6%的患者出现3级及以上AE。
(2)MCLA-129是贝达药业与Merus共同开发的针对EGFR和c-Met双靶点的双特异性抗体。MCLA-129能够同时阻断EGFR和c-Met的信号传导,抑制肿瘤的生长和存活,并且通过增强抗体依赖的细胞介导细胞毒性作用和吞噬作用(ADCC和ADCP),进一步提高对癌细胞的杀伤潜能。MCLA-129拟用于EGFR或MET异常的晚期实体瘤患者的治疗。
2019年1月,贝达药业与MerusN.V.(NDAQ:MRUS)宣布达成战略合作,公司取得在中国开发和商业化MCLA-129的独占实施许可并负责CMC相关工作,Merus公司保留中国以外的所有全球权益。
在2023AACR上,贝达药业披露了MCLA-129的Ⅰ/Ⅱ期试验结果,确定了MCLA-129RP2D为1500mgIVQ2D,在此浓度下对c-MET和EGFR靶点的抑制率可达到95%以上。在18名可评估疗效的患者中,有2名患者为确认的PR,另有4名患者病灶缩小20%以上。
(3)EMB-01是基于岸迈生物专有的FITIg®平台开发的新型双特异性抗体,可同时靶向肿瘤细胞表面EGFR和cMET,正在美国和中国同时进行针对非小细胞肺癌和多个胃肠道肿瘤的I/II期临床试验。除了单药外,岸迈生物正探索EMB-01联合奥希替尼治疗NSCLC。2022年6月,EMB-01联合奥希替尼针对非小细胞肺癌的Ib/II期联合用药的新药临床申请(IND)获得美国食品药品监督管理局(FDA)批准。
(4)HS-20117(PM1080)是一款EGFR/cMet双特异性抗体药物,具有能够同时阻断EGFR和c-Met的信号传导,抑制肿瘤生长和存活等作用的治疗潜力。2022年11月,瀚森制药与普米斯达成协议,翰森制药获得HS-20117在大中华区的开发和商业化独家权利,并向普米斯支付5000万元人民币的首付款及高达14.18亿元人民币的开发、注册及基于销售的商业化里程碑潜在付款,以及基于净销售额的分级特许权使用费。翰森制药引进该产品,旨在进一步开发其单药或与公司研发的三代EGFR-TKI阿美替尼联用的临床价值。
EGFR/cMET三抗:曙光已现
GB263T是嘉和生物旗下一款EGFR/cMET/cMET三特异性抗体,靶向EGFR和两个不同cMET表位,目前处于临床Ⅰ期。临床前研究表明,GB263T有效地阻断了EGFR和c-MET的配体诱导磷酸化,并显示出对EGFR和cMET信号通路更佳的双重抑制。
2022年5月,嘉和生物宣布GB263在澳洲实现首例患者给药。2022年10月,嘉和生物宣布GB263的I/II期临床试验已完成中国首例患者给药,用于晚期非小细胞肺癌和其他实体瘤患者的治疗。
TAVO412是拓创生物旗下一款可靶向EGFR、cMET和VEGF的多特异性抗体,目前处于临床Ⅰ期。TAVO412可以在协同关闭EGFR和cMET信号通路的同时,阻断肿瘤内的血管生成。2023年6月10日,TAVO412注射液的临床试验获国家药监局受理。
小结
MET扩增是三代EGFRTKI重要的耐药机制,因MET基因扩增导致的耐药患者比例高达15%-19%,因此靶向EGFR和c-MET的双抗药物在EGFR-TKI经治的NSCLC患者中有望发挥重要作用。目前,全球仅一款EGFR/cMET药物获批上市,为强生的Rybrevant,随着一线治疗NSCLC及奥希替尼耐药后NSCLC两项适应症均取得积极顶线数据,未来空间可期。国内贝达药业、岸迈生物和瀚森制药的EGFR/cMET双抗均处于临床Ⅰ期,嘉和生物和拓创生物的三抗药物也蓄势待发,有望为晚期NSCLC患者提供更佳的治疗选择。
声明:本文仅作信息传递之目的,并不代表本平台观点。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间核实并处理。
来源:药智头条 ,仅供读者参考,著作权、版权归属原创者所有。转载此文是出于传递更多正能量信息之目的,侵权删






 首页
首页

 癌症科普
癌症科普

 癌症种类
癌症种类

 药品百科
药品百科

 肿瘤医院
肿瘤医院

 名医专家
名医专家

 免费试新药
免费试新药

 健康资讯
健康资讯

 癌症新方案
癌症新方案













