当四小龙纷纷踏上出海之路,国产PD-1的新命题里绕不开“出海”,谁能打响PD-1“出海”第一枪,牵动着整个行业的神经。千呼万唤中,首个国产PD-1闯关FDA“过堂考”结果终于出炉。
10月27日,君实生物和其合作伙伴CoherusBioSciences宣布,FDA已批准特瑞普利单抗注射液(拓益,JS001)上市,适应症为特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌(R/MNPC)患者的一线治疗;其单药也获批用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗。
抓住留白,小适应症也别有洞天
特瑞普利单抗实现了国产PD-1史上FDA的“零突破”,风头似乎已盖过了一个月前在欧盟获EMA批准上市的百济神州替雷利珠单抗。
很多国产创新药都有一个“走向世界”的梦,美国作为世界最大的医药市场,是不少药企的目标,任何一种药物,想要登陆美国市场进行销售,第一关就是获得FDA的许可,同时,FDA批准上市相当于药品拿到了全球通行证,然而,FDA严格的门槛,无形间将很多创新药拒之门外。
这些年,被FDA拒之门外的中国创新药不在少数,例如和黄医药的索凡替尼、信达生物的信迪利单抗等,特瑞普利单抗凭啥能率先叩开FDA大门?适应证的差异化选择成“破局”关键。
作为首个国产PD-1抑制剂,从2018年12月获NMPA批准在中国上市至今已经6年,在中国,特瑞普利单抗已获批了6项适应症,覆盖鼻咽癌、黑色素瘤、尿路上皮癌、非小细胞肺癌、食管鳞癌。其中,联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗,早在2021年11月便在国内获批,并获得FDA授予2项突破性疗法认定和1项孤儿药资格认定。
2020年12月,特瑞普利单抗首次通过国家医保谈判,目前已有3项适应症纳入《2022年药品目录》,是国家医保目录中唯一用于治疗黑色素瘤的抗PD-1单抗药物。
可以说,特瑞普利单抗本身确实足够优秀,这是出海的最初底气所在,但是说实话,每一款去闯关FDA的国产创新药本身都实力在线,比如处在同一赛道的信达生物的信迪利单抗,目前已在国内获批7大适应症,作为唯一一款横跨五大高发癌种(nsq-NSCLC,NSCLC,HCC,胃癌,食管癌)一线治疗的国产原研的PD-1全能选手,信迪利单抗也是“六边形战士”。
可是,信迪利单抗在2022年2月闯关FDA,结局有些“悲伤”,FDA拒绝批准信迪利单抗联合培美曲塞和铂类化疗用于非鳞状NSCLC患者一线治疗的BLA申请,肺癌在美国算是大癌种适应症,FDA独立的ODAC认为,对于在美国上市的大癌种适应症(如肺癌),需要有美国人群不同民族、种族的临床数据。
因此FDA要求信达生物增加国际多中心临床试验,来证明新药能满足不仅包括中国市场,还包括美国甚至全球市场的患者的不同需求,并在美国补做Ⅲ期临床,就这样,信迪利单抗登陆美国市场的计划只能无奈推后。
君实生物或许是看到了PD-1出海队友以及其他国产创新药的FDA折戟经历,显然在特瑞普利单抗的首发适应证的选择上是花了心思的。鼻咽癌在中国常见是常见的疾病,国内也有诸多企业申报,但在美国属于确实小癌种,FDA对小众癌种的监管策略更灵活。
此次特瑞普利单抗获批是基于JUPITER-02和POLARIS-02出色的研究成果,这为特瑞普利单抗联合化疗/单药作为晚期鼻咽癌一线至后线标准疗法提供了确凿证据,本次FDA批准特瑞普利单抗正是使用亚洲人(270例中国大陆、19例中国台湾+新加坡)数据,符合美国“未被满足的临床需求”条件,成功豁免美国本土临床数据而获批上市。
另外,美国尚无PD-1疗法获批用于治疗鼻咽癌,特瑞普利单抗的上市也踩中了美国鼻咽癌的治疗市场的空白地带,相比相继栽了跟头的和黄医药和信达生物,此次君实生物用鼻咽癌适应症打开FDA大门,不失为明智之举。
将进一步提振君实业绩?
特瑞普利单抗成功进军美国市场,对于君实生物无疑是天大的利好消息,照理说二级市场对此类超重磅消息极其敏感,股价大涨甚至涨停也在常理之中,可是,预想中的大涨或涨停并没有到来,10月30日开盘君实股价迎来高开,盘中一度涨超14%,但截至收盘涨幅5.47%,或许我们得从君实生物的产品营收中窥探一二。
27日晚间,君实生物公布2023年三季报,Q3单季实现营收3.17亿元,同比上涨16.31%;归母净利润-4.09亿元。Q1-Q3季度累计营收9.86亿元,同比下降19.04%;归母净利润-14.07亿元。
目前,君实生物拥有3项商业化产品,包括:特瑞普利单抗(拓益)、氢溴酸氘瑞米德韦片(民得维)、阿达木单抗注射液(君迈康)。
其中,君实生物前三季度实现商业化药品销售收入8.92亿元,同比增长67.8%,仅由特瑞普利单抗产生的销售达到6.68亿元,同比增长29.7%,金额占药品销售收入比例高达74.89%,占营收总额比例亦达到67.75%,特瑞普利单抗妥妥地扛起了君实生物的营收大旗。
其实,这几年,君实生物的营收也是高度仰仗特瑞普利单抗,但特瑞普利单抗的销售额一直像坐过山车,起伏不定,2019年,在首个完整销售年度,拿下了7.74亿的销售金额,2020年这一数据飙升到13亿,来到了巅峰;2021年,在市场竞争以及医保降价等因素的叠加之下,销售金额急剧跌到了4.12亿元;2022年,特瑞普利单抗销售7.36亿元,虽然有所回升,但相比同期的国内市场PD-1的前三名仍然有不小的差距。
显然,特瑞普利单抗在国内市场的张力并不好,此次历尽千辛万苦打开的美国市场,是否能提振特瑞普利单抗的销售额?
据世界卫生组织统计,2020年鼻咽癌在全球范围内确诊的新发病例数超过13.1万例,中国以及其他国家、地区每年鼻咽癌新发病例数约10万左右。据合作伙伴Coherus预估,美国每年有2000例鼻咽癌新发患者,其中新增复发/转移性鼻咽癌1500例,当地市场年销售额经爬坡后的峰值,预计2~3年达到最大化的市场渗透率,销售峰值可达2亿美元,
可以肯定的是,特瑞普利单抗此番获批,市场规模将进一步扩大并催化君实生物业绩提升,但特瑞普利单抗在美国最终销售情况如何,还得Coherus用实际行动来验证。同时,虽然特瑞普利单抗打破美国PD-1疗法用于治疗鼻咽癌的空白,但是作为小适应证的鼻咽癌,显然在美国市场对于特瑞普利单抗的业绩贡献空间比较有限,这或许也是资本市场并没有“以股价涨停”为君实生物庆祝的原因。
谁是下一个出海的PD-1?
君实生物在进军美国市场的同时,早已开始布局欧美及全球其他市场,鼻咽癌在欧盟和英国监管机构的上市申请也正在审评中。FDA的获批,进军其他国家的药物市场就容易许多,相信不久的将来,特瑞普利单抗将再迎出海的利好消息。
近年来,国内的PD-1赛道已经极度拥堵,不少企业出海企图在海外市场探索更多可能,除君实生物,恒瑞医药、信达生物、百济神州等都纷纷踏上了出海之路。
一大批国内企业带着自家核心产品在FDA门前排起了长队。
闯关FDA的国产PD-1
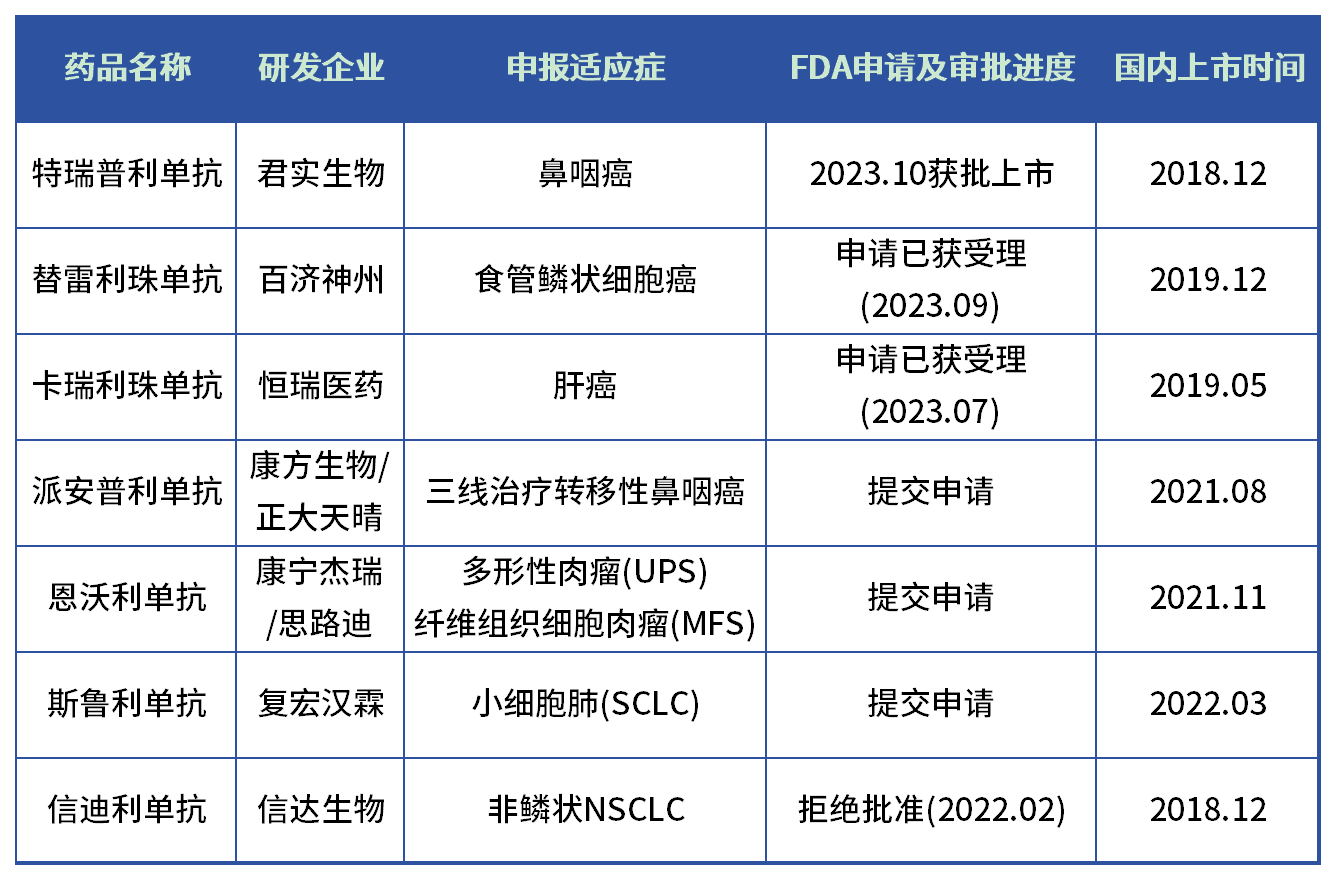
数据来源:公开数据整理
除特瑞普利单抗,百济神州的替雷利珠单抗和恒瑞的卡瑞利珠单抗也是目前闯关FDA大部队里,进展比较快的。
2021年9月,百济神州和诺华联合向FDA提交替雷利珠单抗在美国的上市申请。上个月,在EMA刚批准替雷利珠单抗(百泽安)单药用于治疗既往接受过含铂化疗的不可切除、局部晚期或转移性食管鳞状细胞癌(ESCC)成人患者的适应症,成为首个成功“出海”欧洲的PD-1抑制剂的同时,百济神州宣布FDA也已经受理替雷利珠单抗用于一线治疗不可切除的局部晚期、复发或转移性的ESCC患者上市申请。
今年5月,恒瑞的合作伙伴ElevarTherapeutics向FDA提交了卡瑞利珠单抗和VEGFR抑制剂阿帕替尼(Rivoceranib)联合用于治疗新诊断的不可切除肝癌上市申请,并于今年7月申请获FDA受理,如果恒瑞的这项联合治疗获得批准,将成为继罗氏之后获FDA批准用于肝癌的一线免疫疗法的第二款组合产品。
值得注意的是,康芳生物的派安普利单抗在提交FDA申请时候的首发适应症是三线治疗转移性鼻咽癌,和君实生物类似,以小适应症作为切入点。在2020年10月,派安普利单抗(AK105)用于三线治疗转移性鼻咽癌已获得美国FDA授予的快速审批通道资格(FTD)。但如今3年过去了,派安普利单抗没有特瑞普利单抗“霸气”,还在FDA门前苦苦等待。
此外,复宏汉霖、康宁杰瑞的PD-1单抗都还在审批中,能否登陆美国市场,都是未知数。
不过,君实生物已率先走通,或多或少为PD-1的后来者出海提供有益的借鉴。
但君实生物的成功,谁又能复刻呢?下一个出海美国的PD-1单抗会花落谁家?我们拭目以待。
声明:本文仅作信息传递之目的,并不代表本平台观点。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间核实并处理。
来源:药智头条,仅供读者参考,著作权、版权归属原创者所有。转载此文是出于传递更多正能量信息之目的,侵权删






 首页
首页

 癌症科普
癌症科普

 癌症种类
癌症种类

 药品百科
药品百科

 肿瘤医院
肿瘤医院

 名医专家
名医专家

 免费试新药
免费试新药

 健康资讯
健康资讯

 癌症新方案
癌症新方案













