Q3季度即将结束,国内外创新药进展如何?笔者以NMPA和FDA批准的创新药进行分析。
据统计,2023年Q3季度(截至9月26日)NMPA批准了4款新药,FDA批准了11款新药,以下为具体获批分析。
01
NMPA批准4款创新药
据药智数据统计,2023年Q3季度(截至9月26日)NMPA批准了4款新药,包括2个生物药、1个小分子化药及1个中药复方制剂(即中药3.1类新药)。从适应症上看,其中两款用于治疗肿瘤,一款降脂药。
纳鲁索拜单抗
9月6日,NMPA附条件批准该石药集团附属公司上海津曼特生物科技有限公司开发纳鲁索拜单抗上市,用于治疗不可手术切除或手术切除可能导致严重功能障碍的骨巨细胞瘤成人患者。
该药是重组全人源抗核因子-κB受体活化因子配体(RANKL)单克隆抗体,通过与细胞表面的RANKL特异性结合,抑制RANKL活性,从而抑制其参与介导所引起的骨质溶解和肿瘤生长。
临床试验数据显示,纳鲁索拜单抗治疗不可切除或手术困难的骨巨细胞瘤具有较好的疗效,患者的肿瘤反应率高达93.5%。
舒沃替尼
8月23日,NMPA附条件批准迪哲(江苏)医药股份有限公司申报的1类创新药舒沃替尼片(商品名:舒沃哲)上市。
该药适用于既往经含铂化疗治疗时或治疗后出现疾病进展,或不耐受含铂化疗,并且经检测确认存在表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)的成人患者。
目前,全球仅有两款EGFR/Exon20ins EGFR药品实现上市销售,分别为强生的Amivantamab和武田制药的莫博赛替尼。面对主要竞品,舒沃替尼疗效和安全性更优,且对基线伴有脑转移患者具有良好的抗肿瘤活性。
托莱西单抗
8月17日,NMPA批准了信达生物制药(苏州)有限公司申报的托莱西单抗注射液(商品名:信必乐)上市。托莱西单抗注射液为前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂,用于降低血脂。
据悉,托莱西单抗注射液为国内首个获批的国产自主研发PCSK9抑制剂,同时托莱西单抗注射液也是信达生物布局心血管疾病领域的首款产品。
中药复方制剂枇杷清肺颗粒
7月27,吉林敖东洮南药业股份有限公司按古代经典名方目录管理的中药复方制剂(即中药3.1类新药)枇杷清肺颗粒通过技术审评,获批上市。
枇杷清肺颗粒可清肺经热,用于肺风酒刺,症见面鼻疙瘩、红赤肿痛、破出粉汁或结屑等。
02
FDA批准11款创新药
同期,FDA批准了11款新药,与前两个季度比,略有下降(第一、二季度,分别批准了13个药物)。
表1 2023年Q3 FDA批准的药物
(黑色为小分子化药,蓝色为生物药)
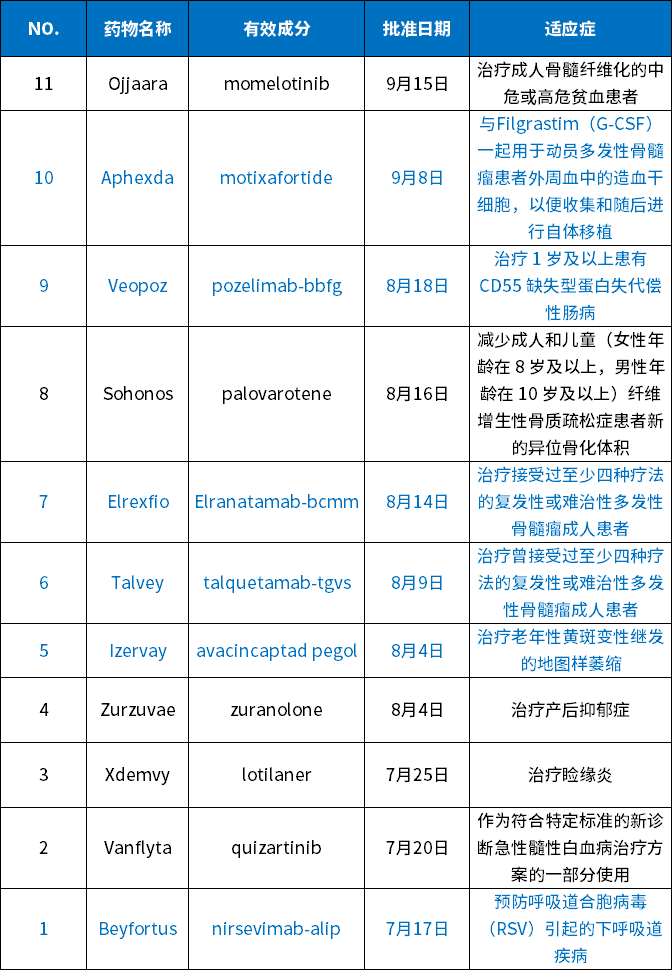
数据来源:药智数据
从类型上看,有6个生物药(4个抗体,2个多肽)和5个小分子化药。小分子占比45%,表明全球创新药物中,小分子依然占据重要份额,这与国内创新药物,偏重于生物药形成了鲜明对比。
从适应症方面看,本季度FDA批准的药物依然适应症广泛,涵盖了肿瘤、骨髓纤维化、炎症、病毒感染等方面,其中包含多种首创疗法。本季度FDA批准的药物,有5个适用于肿瘤疾病,都是与骨髓和血液相关的肿瘤性疾病,分别是Ojjaara、Aphexda、Elrexfio、Talvey和Vanflyta。这是本季度FDA批准药物的最大特色。
在罕见病方面,第三季度FDA批准了2款药物,分别是针对CHAPLE病的Veopoz和针对石人综合症的Sohonos。这两个药物均是针对相关疾病的首创疗法,代表了小分子与生物药在罕见病领域均具有极大的潜力。
下面重点介绍FDA批准的小分子化药。
Ojjaara(momelotinib)
9月15日,FDA批准了葛兰素史克公司开发的Ojjaara(momelotinib),用于治疗伴有贫血的成人中度或高风险骨髓纤维化,包括原发性骨髓纤维化或继发性骨髓纤维化(真性红细胞增多症后和原发性血小板增多症后)。
Ojjaara是一种一天一次的口服JAK1/JAK2和激活素A受体1型(ACVR1)抑制剂。
迄今为止,它是唯一获准用于新诊断和既往接受过治疗的骨髓纤维化贫血患者的药物,可治疗该病的主要表现,即贫血、体征和脾肿大(脾脏增大)。
Sohonos™(palovarotene)
8月16日,FDA批准了益普生公司开发的Sohonos™(palovarotene)胶囊作为一种维甲酸类药物,是首个治疗用于减少患有渐进性纤维性骨化症(FOP,俗称“石头人症”)的成人和8岁及以上女性和10岁及以上男性儿童患者的新生异位骨化体积。
Palovarotene是一种口服的选择性视黄酸受体γ(RARγ)激动剂,介导视黄素信号传导途径中的受体、生长因子和蛋白质之间的相互作用,以减少新的异常骨骼的形成。
目前,Palovarotene已在美国以及加拿大获批上市,并在阿拉伯联合酋长国获得有条件批准,但欧盟拒绝了其上市申请。
Zurzuvae(zuranolone)
8月4日,FDA批准了渤健&Sage开发的Zurzuvae(zuranolone),用于治疗成人产后抑郁症(PPD)。Zurzuvae是首款也是唯一一款可快速改善PPD女性抑郁症状的口服药物。
该药是一种合成的、口服活性的、抑制性孕烷神经甾体,并作为GABAA(γ-氨基丁酸A型)受体的正变构调节剂,具有高口服生物利用度和适合每日一次给药的生物半衰期。
Xdemvy(lotilaner)
7月25日,FDA批准Xdemvy(lotilaner眼科溶液)0.25%用于治疗睑缘炎。Xdemvy的前身是TP-03,是FDA批准的第一种也是唯一一种直接针对睑缘炎根源——螨虫的治疗药物。
该药物主要通过选择性抑制螨虫的GABA氯离子通道来根除蠕形螨的分子,目前在中国已启动III期注册临床研究。
Vanflyta(quizartinib)
7月20日,FDA已批准了第一三共开发的Vanflyta(quizartinib),联合标准阿糖胞苷和蒽环类诱导化疗,以及标准阿糖胞苷巩固化疗,以及作为维持单药治疗,用于治疗新诊断的FLT3-ITD突变阳性急性髓性白血病(AML)。
Vanflyta是一种口服的高效II型FLT3抑制剂,可选择性靶向FLT3-ITD突变。此前于2019年首次获批作为单一疗法,用于治疗患有复发性/难治性FLT3-ITD突变AML的成年患者。
从第三季度获批的新药来看,本土制药企业的研发实力稳步提升,尤其是生物药方面,部分产品达到了中上游水平,但是小分子化学药创新方面,明显不足,结构老旧,靶点不新。
而FDA批准的新药,小分子药物依然达到半数,涵盖适应症范围广。这与欧美制药企业在研发上的投入、科研资源方面的优势、丰富的研发团队和设备,以及更成熟的创新技术等因素是分不开的。
相比之下,由于生物药的强势崛起,国内刮起了唱衰小分子化药的风气,笔者认为,此时应该正视差距、奋起直追,最终达到遥遥领先。
来源:药智网,本文观点仅代表作者本人,仅供读者参考,著作权、版权归属原创者所有。转载此文是出于传递更多正能量信息之目的,侵权删






 首页
首页

 癌症科普
癌症科普

 癌症种类
癌症种类

 药品百科
药品百科

 肿瘤医院
肿瘤医院

 名医专家
名医专家

 免费试新药
免费试新药

 健康资讯
健康资讯

 癌症新方案
癌症新方案













