美国时间12月8日,美国食品药品监督管理局(FDA)宣布,批准CRISPR/Cas9基因编辑疗法Casgevy(exa-cel)上市,用于治疗镰状细胞病(SCD)。
SCD会使血细胞折叠成新月形,从而更容易聚集在血管中,导致肌肉缺氧。患者需要接受输血治疗,但仍然时刻面临着中风和剧烈疼痛的威胁。这种疾病还使患者容易出现一系列其他并发症,如贫血、黄疸、感染、胆结石和器官损伤。
FDA批准的第一款CRISPR基因编辑疗法
Casgevy由福泰制药和CRISPRTherapeutics共同研发。CRISPRTherapeutics的创始人之一是德国马克斯·普朗克病原学研究所的EmmanuelleCharpentier,她和美国加州大学伯克利分校的JenniferDoudna因在基因编辑技术方面的开创性成果而共同获得2020年诺贝尔化学奖。
11月16日,英国药品和保健产品监管机构(MHRA)批准Casgevy有条件上市许可,用于治疗镰状细胞病(SCD)和输血依赖性地中海贫血(TDT)。Casgevy成为全球首款获批上市的CRISPR基因编辑药物。
据FDA新闻稿称,Casgevy也是FDA批准的第一种新型基因组编辑疗法,标志着基因治疗领域的创新进步。
在上市之前,Casgevy的获批之路也并非一帆风顺,也曾面临着监管机构的质疑和担忧。
尽管业内专家们称赞Casgevy是SCD治疗方法的一项重大突破,但他们一致认为,要简化其管理并确保其安全性和可靠性,还有很长的路要走。
在10月份举行的FDA咨询委员会会议上,波士顿儿童癌症和血液疾病中心的DanielBauer博士介绍了一项研究,该研究表明CRISPR可能导致意想不到的突变。在上周的另一次会议上,他还提到,Casgevy仍然是一种非常具有挑战性的疗法,需要收集干细胞,进行体外操作,并用化疗来消融血液系统,但他也强调Casgevy的获益大于风险。
面对质疑与担忧,Casgevy用数据自证。
6月份报告的中期数据显示,在接受治疗的16名镰状细胞患者中,有15人(94%)至少连续12个月没有出现疼痛发作(也称为血管闭塞性危象),达到了研究的主要终点。Vertex和CRISPR对此表示,这种益处预计将是终身性的。
另一项针对TDT患者的试验显示,89%的患者达到了至少连续12个月不输血的主要终点。FDA计划在明年3月30日前就Casgevy在该适应症中的应用做出决定。
定价220万美元
基因疗法通常有着“天价药”标签。根据美国证券交易委员会(SEC)的一份文件,福泰制药和CRISPR将Casgevy定价220万美元,而比起与其同时获批的来自蓝鸟生物另一款基因疗法Lyfgenia的310万美元定价,以及其他几款已经上市的基因疗法定价,Casgevy还不算“天花板”。
下表1为当前全球售价最贵的6种药物,价格均在200万美元以上。
表1单价破200万美元药物
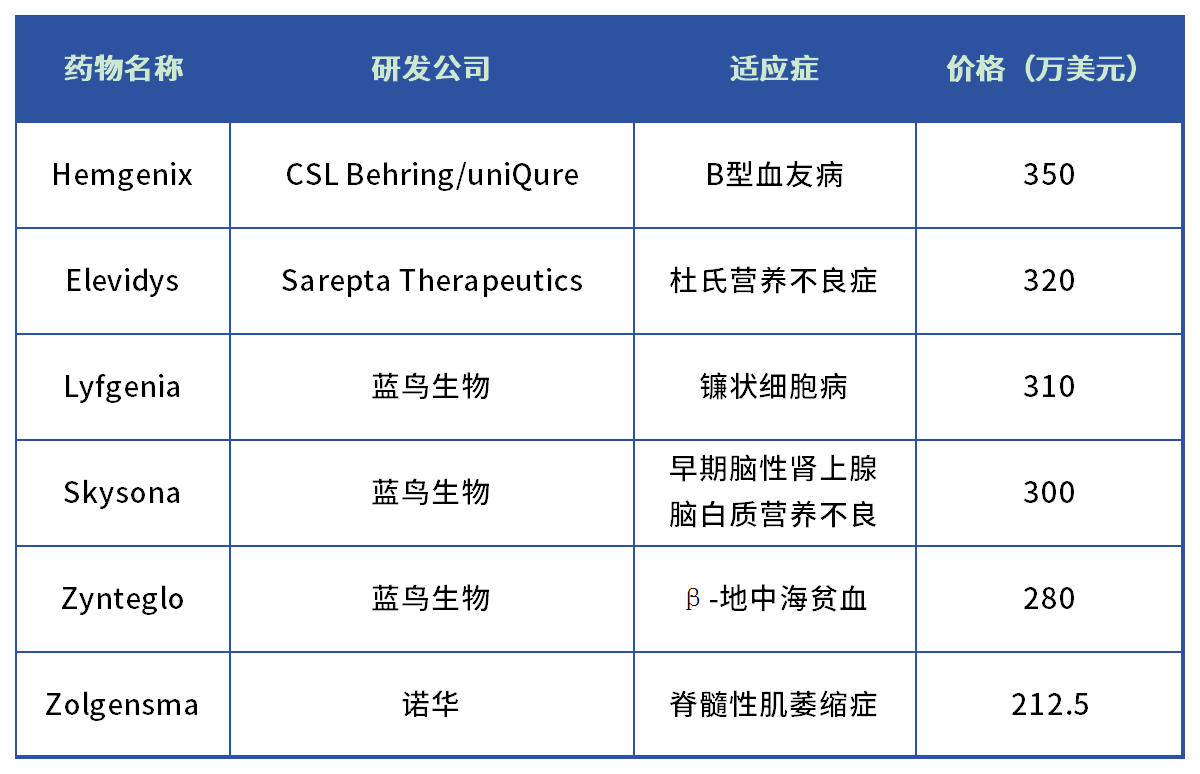
数据来源:公开资料整理
第1名则是由CSLBehring和uniQure共同研发的Hemgenix,该药物为基于AAV载体的基因疗法,主要用于B型血友病患者的治疗,定价350万美元/剂,理论上该药物可终身只打一针即可持续起效。
第2名则是由Sarepta和罗氏共同开发的Elevidys,该药物定价320万美元/剂。该药物用于治疗杜氏肌营养不良患者,该药物也是全球第一款杜氏肌营养不良基因疗法药物。
第3名、第4名和第5名均由蓝鸟生物包揽,分别为Lyfgenia、Skysona和Zynteglo,定价分别为310万美元、300万美元、280万美元,适应症分别为镰状细胞病、早期脑性肾上腺脑白质营养不良和β-地中海贫血。
第6名则是由诺华研发的Zolgensma,主要用于治疗脊髓性肌萎缩症患者,定价212.5万美元/剂。
本图文来源于【 药智头条】仅供读者参考,著作权、版权归属原创者所有。转载此文是出于传递更多正能量信息之目的,侵权删






 首页
首页

 癌症科普
癌症科普

 癌症种类
癌症种类

 药品百科
药品百科

 肿瘤医院
肿瘤医院

 名医专家
名医专家

 免费试新药
免费试新药

 健康资讯
健康资讯

 癌症新方案
癌症新方案













