11月13日,传奇生物宣布与诺华制药公司(Novartis Pharma AG)就传奇生物的特定靶向 DLL3的嵌合抗原受体T细胞(CAR-T)疗法签订了独家全球许可协议,包括其自体 CAR-T 细胞疗法候选药物 LB2102 。
根据许可协议,传奇生物将获得1亿美元的预付款,并有资格获得高达10.1亿美元的临床、监管和商业里程碑付款以及分级特许权使用费。
传奇生物将在美国进行LB2102的I期临床试验,用于治疗广泛期小细胞肺癌和大细胞神经内分泌癌,诺华将进行许可产品的所有其他开发。此前,美国FDA 授予候选产品“孤儿药”称号。
强强联手,挑战CAR-T治疗肺癌,这不是传奇生物CAR-T产品第一次出海。
此前,2017年,传奇生物自主研发的BCMA CAR-T疗法LCAR-B38M/JNJ-4828亮相美国临床肿瘤学会年(ASCO),凭借100%的客观缓解率惊艳全场。
同年12月,传奇生物与强生签订了一项全球合作和许可协议,共同开发和商业化LCAR-B38M/JNJ-4828。强生向传奇生物支付3.5亿美元首期款及后续里程碑付款,创下了当时中国药企对外专利授权首付款最大金额纪录及合作最优条件。
2022年2月28日,传奇生物的BCMA CAR-T产品Ciltacabtagene autoleucel(cilta-cel,西达基奥仑赛,商品名为Carvykti)获美国FDA批准,用于治疗复发或难治性多发性骨髓瘤患者。Carvykti是FDA批准的首个国内自主研发的CAR-T产品。
在关键的CARTITUDE-1研究中,97例R/R MM患者出现了早期、深度持久的缓解,总缓解率(ORR)高达98%(95%CI:92.7-99.7),78%的患者获得了严格的完全缓解(sCR,95%CI:68.8-86.1)。在18个月的中位随访时间中,中位缓解持续时间(DOR)为21.8个月(95% CI,21.8-无法预估)。
获批当年,Carvykti销售额达到1.34亿美元。今年前三季度,Carvykti合计销售额3.41亿美元,全年销售额预计将超过5亿美元。
时隔6年,传奇生物CAR-T产品再次与跨国大药企达成合作。本次传奇选择的合作对象是诺华。
2017年,全球首款CAR-T新药Kymriah获得FDA批准上市,开发者正是诺华。
药智数据显示,截至目前全球已上市的10款CAR-T产品,其中FDA批准了6款,国内的4款。
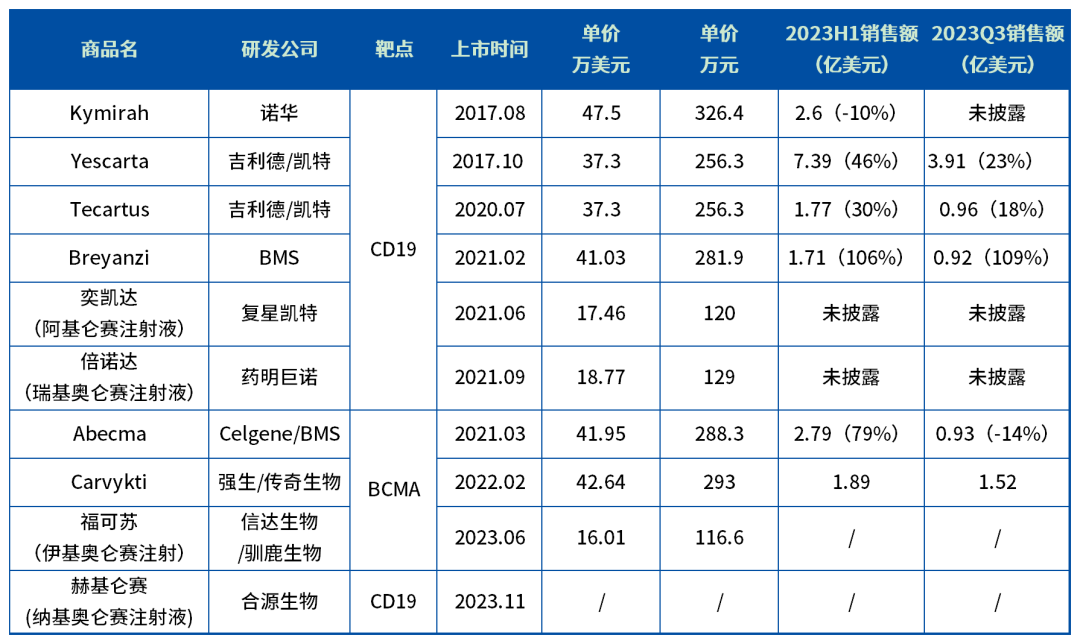
全球已上市CAR-T产品及部分产品销售情况,数据来源:公开数据整理
这些获批的CAR-T适应症均为血液肿瘤。
本次传奇生物与诺华合作的LB2102是一款靶向δ样配体3(DLL3)的CAR-T。这种配体高度局限于各种恶性肿瘤,包括小细胞肺癌、大细胞神经内分泌肺癌(LCNEC)、某些其他部位神经内分泌癌和前列腺癌。
据传奇生物新闻稿,LB2102具有创新的CAR设计和装甲机制,可以增加其抗肿瘤活性。
诺华T-Charge平台是下一代CAR-T细胞疗法生产平台,旨在保持T细胞的干性,并促进CAR-T细胞主要在体内扩增。T-Charge平台旨在减少在体外长时间培养的需求,使T细胞具有更大的增殖潜力,并减少耗竭的T细胞。LB2102中独特的候选设计与T-Charge平台相结合,有可能为小细胞肺癌患者带来变革性的获益。
传奇生物与诺华的强强联合,有望将CAR-T疗法在实体瘤领域的应用变为可能。
中国创新药出海成为常态
近年来,越来越多的中国创新药走向全球。
除了传奇生物的CAR-T疗法,在海外获批上市的国产创新药还有和黄医药的呋喹替尼、君实生物的特瑞普利单抗、百济神州的泽布替尼和替雷利珠单抗、天济医药的本维莫德、微芯生物的西达本胺等。
还有更多国产创新药正通过借“船”出海、License out的方式将自己产品推向国际市场。仅今年就已有40多项跨国交易达成,涉及多款CAR-T疗法、抗体疗法及小分子药物。
中国正在成为新的创新药“世界工厂”,在各领域扮演重要角色。
表1. 2023年国产创新药license out项目

声明:本文仅作信息传递之目的,并不代表本平台观点。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间核实并处理。
来源:数据为药智数据、药智头条整理作者手动整理,并非全部license out项目,仅供读者参考,著作权、版权归属原创者所有。转载此文是出于传递更多正能量信息之目的,侵权删






 首页
首页

 癌症科普
癌症科普

 癌症种类
癌症种类

 药品百科
药品百科

 肿瘤医院
肿瘤医院

 名医专家
名医专家

 免费试新药
免费试新药

 健康资讯
健康资讯

 癌症新方案
癌症新方案













