21世纪作为生物的世纪,在医疗界的表现之一,便是大分子创新药的快速壮大。
我国大分子创新药虽然起步较晚,但发展速度惊人,在研项目众多。例如,2018-2023年已有12款国产PD-(L)1抗体在国内上市,包括8款PD-1单抗、3款PD-L1单抗和1款PD-1/CTLA-4双抗。
面对激烈的竞争和产能过剩,企业将目光瞄向了更广阔的国际化市场。
日前,君实生物自主研发的抗PD-1单抗药物特瑞普利单抗(美国商品名:LOQTORZ)在美国获批2项适应症,覆盖晚期鼻咽癌全线治疗。特瑞普利单抗由此成为FDA批准上市的首个中国自主研发和生产的创新单抗药物。这也是美国首个且唯一获批用于鼻咽癌治疗的药物,填补了美国鼻咽癌的治疗空白。
一个月前,9月19日,百济神州的抗PD-1单抗药物替雷利珠单抗(欧盟商品名:TEVIMBRA)获欧盟委员会(EC)批准,作为单药用于治疗既往接受过含铂化疗的不可切除、局部晚期或转移性食管鳞状细胞癌(ESCC)的成人患者。替雷利珠单抗是首款在海外上市的国产PD-1单抗。
更早的2022年2月28日,传奇生物的靶向BCMA CAR-T产品Ciltacabtagene autoleucel(cilta-cel,西达基奥仑赛,商品名为Carvykti)获美国FDA批准,用于治疗复发或难治性多发性骨髓瘤患者。Carvykti是FDA批准的首个国内自主研发的CAR-T产品。获批当年,Carvykti销售额达到1.34亿美元。今年前三季度,Carvykti合计销售额3.41亿美元,全年销售额预计将超过5亿美元。
还有更多的国产创新药正在走向国际市场……
在近日药智网主办、药智传媒承办的《药智会议·云智会 | 出海远航,大分子药的商业化之路》会议上,康洲医药大数据研究院副院长刘中卫博士担任主持人,与江苏理工学院生物信息与医药工程研究所所长常珊教授,暨南大学基础医学院教授、博士生导师费嘉教授,北京海金格医药科技股份有限公司医学总监刘永升博士三位嘉宾,共同探讨了大分子创新药出海之路。
/ 01 /
创新药出海加速
近年来,License out模式是大分子创新药出海最重要的途径,而在交易数量、金额及项目种类方面呈逐年增高态势。
据药智头条统计,今年前10个月,国产创新药license out交易40余笔,涉及金额超过250亿美元。这些交易中以大分子创新药为主,小分子创新药占少数。
表1. 2023年1月-10月国产创新药license out项目
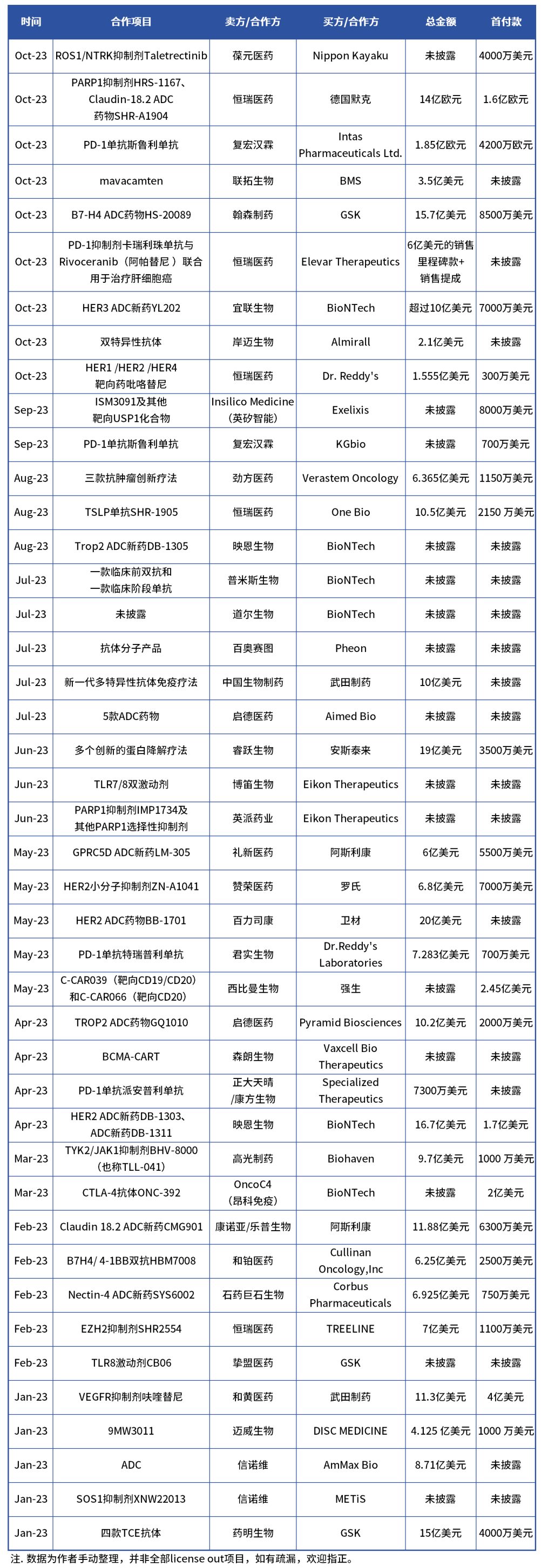
数据来源:药智数据、药智头条整理
谈及创新药为什么要出海?
费嘉认为,创新药出海虽然未必很迫切,中国是世界排名第二得医药市场,而且每年增长速度较快,前景可观。但与美国市场相比,仍有很大差距,所以创新药出海有很大的诱惑性。而且国内还面临内卷以及集采政策与国家医保谈判所带来的药价压力,所以在当下,扬帆出海不失为一个好的选择。
常珊认为,国外市场更鼓励去探索一些更新的靶点和适应症。对于比较新的靶点,出海是一个机会。
出海方式有很多,总体上可以被分为三种:自主出海、借“船”出海、联手出海。其中第二种借“船”出海,是国内药企最常采用的方式。企业通过License out,将自己产品的海外/全球权益卖给海外企业,他们来负责后续的临床开发、申报上市、生产和销售等工作,并获得阶段性收益。
刘永升认为近几年license out呈现井喷式的增长,主要得益于国家政策的支持、创新技术研发涌现、资本加持以及海外医药人才的回流。
但是,他也提醒大家,“license out是一把双刃剑”。企业通过这种方式能够获得较大且快速的收益,迅速降低研发支出,获得更充足的现金流。然而,license out也会让渡一部分权益给合作伙伴,增加了不确定因素。
另外,专家们普遍认为,出海的门槛相对较高,并非所有企业都适合。因此,要想成功出海,企业必须具备真才实干,正如打铁需要自身过硬。
/ 02 /
创新药出海成功的关键因素
四位专家从成功和失败两方面的案例入手,分析了创新药出海应考虑的因素。
靶点具有创新性。例如,传奇生物的Carvykti具有靶点创新性,传奇生物是全球最早进行BCMA靶点研究的企业之一,传奇立项时在这一靶点进行研发的企业很少。
满足临床未满足的需求。例如,君实生物的特瑞普利单抗,虽然在靶标上没有原始创新,但鼻咽癌适应症满足了临床未满足的需求,该药是美国首个且唯一获批用于鼻咽癌治疗的药物,填补了美国鼻咽癌的治疗空白。
研究和申报的流程要符合FDA、EMA标准。例如,在临床试验设计的时,就要考虑全球多中心临床,在临床终点、种族差异等方面要符合药品拟上市地区要求。
好的合作伙伴。例如,传奇生物与强生合作,强生支付了3.5亿美元的先期资金,并在开发与监管等关键阶段提供了额外资金,支持Carvykti的快速开发及上市。上市后,凭借强生强大的销售能力,Carvykti销售额快速增长。
总而言之,如果有出海的想法,一定要提前做好准备。企业要有差异化的产品,发现合适的应用场景,并熟悉国际化法规,拥有国际化的人才,才谈得上出海。
/ 03 /
退货不可怕,好产品不愁卖
今年创新药出海热情高涨,license out数量大增。但与此相对应的,“退货”数量也开始多了起来。
9月,百济神州宣布,其PD-1替雷利珠单抗在欧洲获得了首个适应证。与此同时,百济神州与诺华终止了授权协议,重新获得了开发、生产和商业化替雷利珠单抗的全部全球权利。而今年7月,诺华没有行使选择权,百济神州宣布诺华终止TIGIT单抗合作。
10月,科伦药业发布公告披露了科伦博泰与 MSD合作的进展。默沙东终止科伦博泰的一项临床前ADC资产的独家许及另一项临床前ADC的独家选择权。
刘永升分析了“退货”的几种原因。第一,企业管线的调整,比如,诺华战略的调整退回了百济神州的PD-1单抗;艾伯维临床管线调整,先后退货加科思和天境生物。第二,合作企业自身经营问题,比如,EQRx由于自身经营不善,商业化前景暗淡,“退回”了基石药业的两款抗肿瘤药物权益。第三,产品原因,比如,Incyte公司评估恒瑞的PD-1单抗不良反应后选择退货;礼来因为信达的PD-1单抗闯关FDA失败退货。
随着出海的项目越来越多,企业调整管线或项目进展不顺被退货自然也会变多。
在中国医药行业高速发展的背景下,刚开始走国际化道路时,我们可能会遇到许多困难和不熟悉的东西。当中国所有技术准备走向世界时,都会面临同样的问题。但从长远来看,困难是暂时的。传奇生物、君实生物、百济神州等企业已经率先成功踏出出海的第一步,值得我们去学习。引用鲁迅先生的一句话:“其实地上本没有路,走的人多了,也便成了路。”只要我们修炼好内功,相信不久后将看到更多的中国创新药在全球市场占有重要一席之地。
声明:本文仅作信息传递之目的,并不代表本平台观点。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。如涉及作品内容、版权和其它问题,请在本平台留言,我们将在第一时间核实并处理。
来源:药智头条,仅供读者参考,著作权、版权归属原创者所有。转载此文是出于传递更多正能量信息之目的,侵权删






 首页
首页

 癌症科普
癌症科普

 癌症种类
癌症种类

 药品百科
药品百科

 肿瘤医院
肿瘤医院

 名医专家
名医专家

 免费试新药
免费试新药

 健康资讯
健康资讯

 癌症新方案
癌症新方案













