近日,诺和诺德宣布,其“黄金大单品”司美格鲁肽用于治疗合并肾功能不全二型糖尿病患者和慢性肾病的三期临床FLOW(代号)由于疗效优异提前终止。
按原定计划,FLOW自2019年正式启动入组,计划在28个国家的418个研究地点进行,预计入组3524例肾病患者,计划试验时间约5年。
换言之,按原计划,顺利的话是2024年完成入组,最快也要到2025年公布试验结果,现在预计揭盲的临床数据在2024年上半年读出,至少提前了一年。
FLOW临床提前宣告成功,明显超出了市场的预期,为司美格鲁肽抢夺新一代“药王”再添一把火。
新药研发,历来有九死一生之说,由于临床研发失败而不得已终止试验的案例比比皆是。但是,因为临床试验结果太优异而提前中止的却是凤毛麟角。
试验提前终止需要什么样的条件?还有哪些药物因疗效优异而停止临床试验?
01
珠玉在前,瓦石难当,新一代药王“司美格鲁肽”
司美格鲁肽减肥适应症横空出世,使得该药逐渐走上医药舞台中央。除了降糖、减肥适应症外,司美格鲁肽正积极扩展其他适应症,慢性肾病就是其中之一。
慢性肾脏病(CKD)是2型糖尿病(T2DM)常见的合并症,由于CKD的发病时间大多很长(10-20年),而且期间症状不明显,临床确诊多见肾衰竭乃至终末期肾病,死亡率极高。
临床上,慢性肾脏病的评价和检测指标主要有2个,尿白蛋白肌酐比(UACR)和肾小球滤过率(eGFR)。
UACR是评估慢性肾脏病患者蛋白尿的主要指标,UACR越高,发生糖尿病、高血压、外周血管病变的风险越高;eGFR则是肾小球滤过能力的客观指标,一旦eGFR值下降至15ml/min·1.73m2,则代表肾功能丧失,称为肾衰竭期。
FLOW的主要终点包括eGFR持续降低幅度超过50%、至eGFR持续小于15ml/min/1.73m2的时间、至透析或肾移植的时间、因肾病或心血管疾病死亡率。
据真实世界研究数据(数据来源:期刊ClinicalKidneyJournal),患者注射司美格鲁肽12个月后,不仅血糖控制和体重水平都明显改善,而且UACR水平大于300mg/g的患者(大量蛋白尿期病人)中,尿白蛋白水平下降超过50%,初步确定司美格鲁肽显著降低了T2D合并CKD患者达到肾脏符合结局(即肾衰竭、肾死亡)的发生率。
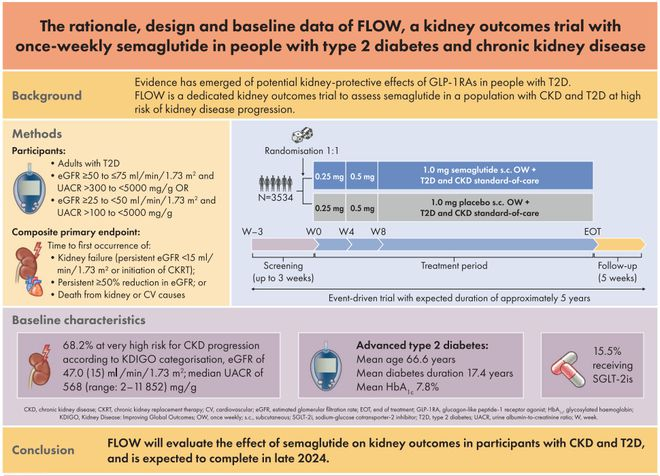
图1 FLOW临床试验设计
图片来源:诺和诺德官网
此外,诺和诺德已在全球开展了三百多项司美格鲁肽的临床,已基本铺平了安全性的道路。
作为诺和诺德的业绩动力主要来源之一,司美格鲁肽2023H1总销售额已超过90亿美元。
2022年,司美格鲁肽全年销售额为109亿美元,随着2型糖尿病、肥胖症、慢性肾脏病的先后爆发,以及极具看头的糖尿病眼病、NASH、阿尔茨海默病试验,2023年全年有望突破200亿美元。
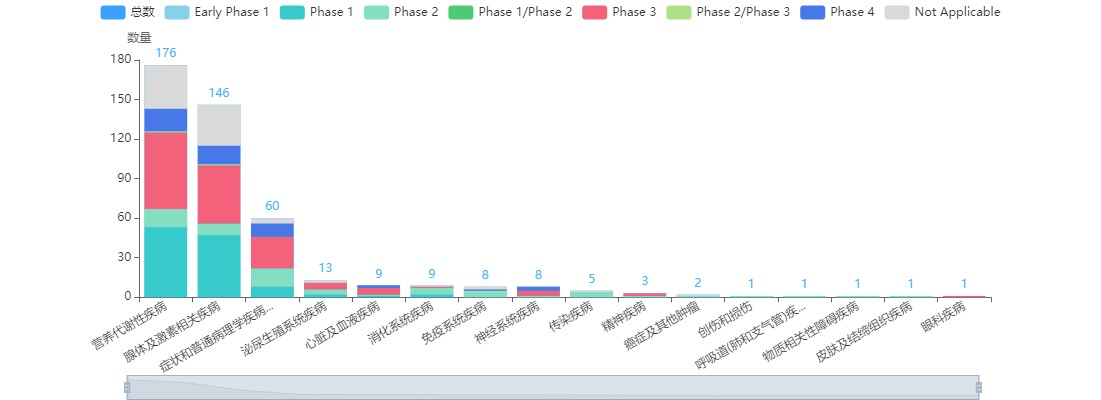
图2 司美格鲁肽的全球临床试验情况
图片来源:药智数据
这款被减肥“耽误”的“潜在药王”,正在威压着其他适应症领域的公司。
包括这一次,在FLOW临床宣布提前终止后,两大血透巨头费森尤斯和百特国际分别在盘后下跌了8.11%、3.56%。此前宣布GLP-1多靶点对NASH有较好效果的时候,国内外众多NASH公司的股价在短时间内也打下了较大跌幅。
不由得感叹,司美格鲁肽,真的太强了!
02
BIC中的“战斗机”,盘点提前终止临床试验的「司美格鲁肽们」
试验提前终止需要什么样的条件?这就要从临床试药坚持的原则之一说起,clinicalequipoise,可以译成临床均势或临床平衡。
在开展临床试验的时候,设计者对参予比对的两种或多种疗法,是不知道哪一个效果更好。
为了保证大家可能得到的益处和面临的风险与机会都是均等的,一般使用随机方式把参与试验的病人分进各个治疗组,以便于反映了临床研究中尊重、受益、和公正的三大原则。
因为临床均势被打破而叫停的试验曾经多次发生,但是大部分都不是什么好事,比如招募不到患者,效果不明显,不良反应过多,试验方资金不足等。
反过来说,剩余的小概率事件,就是好事,也是所有人最希望看到的,即试验效果太好而提前终止。
为了尽量提高试验参与者的收益并减少风险,很多临床试验会委托独立的数据监察委员会对试验的数据进行实时分析,当委员会发现当前的数据已经足够给出结论的时候,试验就可以提前终止了。
因为参与比对疗法的临床均势已经被现有数据打破,继续进行的话,违反了临床均势假设,对新征招的以及继续参与试验的病人来说,被分配进疗效低的治疗组的病人显然面临不公平的待遇。
近些年来,因为试验效果太好而提前终止的案例不多,这里列举代表性的。
表1 因试验效果太好而提前终止的临床案例(部分)

数据来源:公开数据整理
除了这次火爆的司美格鲁肽,今年9月底,阿贝拉昔单抗因出血明显少于利伐沙班提前终止研究。
阿贝拉昔单抗是一种高度选择性的全人源单克隆抗体,具有针对XI因子和XIa因子的双重抑制作用。
2年前阿贝拉昔单抗预防深静脉血栓的ANT-005TKA研究发布在新英格兰医学杂志,患者只需要术后注射一针便可有效预防深静脉血栓且出血副作用很低。
今年9月,阿贝拉昔单抗获得美国FDA的快速通道指定,可用于预防房颤患者卒中和全身性栓塞。
由于XI/XIa因子抑制剂-阿贝拉昔单抗显著减少了出血并发症,AZALEA-TIMI71研究提前终止;对照组患者可以选择从利伐沙班组转换到阿贝拉昔单抗组。
另外一款则是心衰药物Entresto。Entresto是血管紧张素II抑制剂缬沙坦和脑啡肽酶抑制剂AHU-377的复方组合。在PARADIGM-HF的三期临床中,Entresto和标准疗法依那普利比降低20%心脏病死亡率,实验被提前终止,成为20年来首个心衰新药,而且目前不存在有力的竞争对手。
新药研发有FIC、BIC、Metoo、Meworse,而因试验效果太好而提前终止则是BIC中的“战斗机”,可以说是创新药研发领域的最高“殿堂”。
怎么样才能成为新药研发的“战斗机”?除了必备的运气之外,更多的是从研究疾病和靶点开始做源头创新的坚持和努力。
坚持源头创新不是坐而论道,是要瞄准真正临床需求,填补临床空白、突破性创新分子设计、优化治疗方式、变革治疗手段。这些都需要以上下游研发全链条实力和积累作为支持,才能开发出经得起锤炼的产品。
希望有一天,国内也拥有享誉全球的因试验效果太好而提前终止的重磅炸弹管线。
来源:药智网/乖扁豆,仅供读者参考,著作权、版权归属原创者所有。转载此文是出于传递更多正能量信息之目的,侵权删






 首页
首页

 癌症科普
癌症科普

 癌症种类
癌症种类

 药品百科
药品百科

 肿瘤医院
肿瘤医院

 名医专家
名医专家

 免费试新药
免费试新药

 健康资讯
健康资讯

 癌症新方案
癌症新方案













